PMA光解儀在活菌檢測中的應用
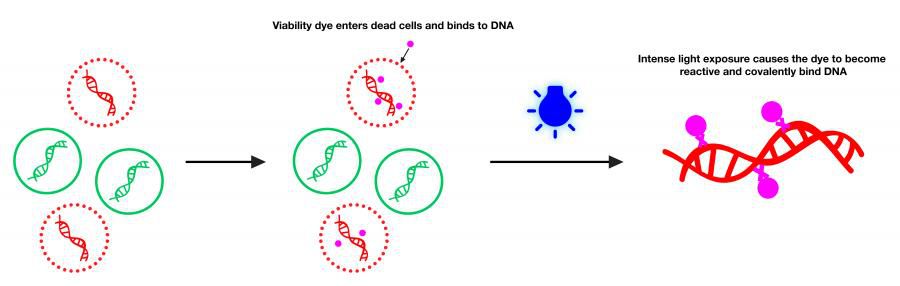
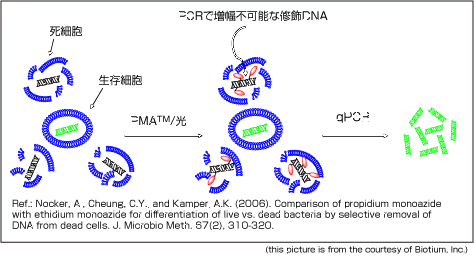
PMA是一種高親和性的DNA結合染料,尤其與雙鏈DNA,該染料本身具有微弱的熒光,但與核酸結合后可以發出更為明亮的熒光。PMA具有細胞膜不可滲透性,因此可選擇性地修飾膜受損的死細胞的DNA。PMA修飾的DNA經LUYOR-3419PMA光解儀藍光(~464 nm)光解后,PMA上的光反應性疊氮基轉化為高反應性氮烯自由基,與DNA結合位點附近的任何烴部分反應形成穩定的共價氮碳鍵,從而導致性DNA 修飾。該修飾過程會使DNA不溶,且在后期的基因組DNA提取過程中與細胞碎片一起丟失。殘留在溶液中未結合的PMA,在強光照射下與水分子反應分解成無交聯活性的羥胺化合物,使其不能再共價結合DNA。基于PMA的這一特性,我司將PMA與qPCR技術相結合,形成一種新的檢測方法—PMA-qPCR,用于活細菌的篩選。目前該法已在多種細菌菌株以及酵母、真菌、病毒和寄生蟲中得到驗證。
復雜樣品的處理,如糞便或土壤,可能會需要優化樣品稀釋度、染料濃度和光處理時間。稀釋樣品的處理,如水測試,可能需要在染料處理前進行過濾或濃縮。
疊氮溴化丙錠的介紹
疊氮溴化丙錠(?PMA)是一種光敏反應染料,它對DNA具有非常高的親和力。當細胞膜處于不完整狀態或者細胞已經死亡,細胞膜對外界的物質的進出就沒有了選擇性,PMA就可以順利進入細胞內,與DNA進行結合,在LUYOR-3419PMA光解儀光照作用下發生交聯反應。交聯后的DNA就不能作為模板進行擴增,殘留在溶液中的未被結合的PMA在光照下與水分子形成羥胺化合物,從而阻止其與在提取過程中活菌產生的DNA結合,影響檢測結果。而對于活的細胞而言,細胞膜具有選擇性,PMA便不能進入細胞內與DNA進行交聯反應。將PMA這種特性與熒光定量PCR技術進行偶聯,便可以實現對活菌的檢測。
影響活菌檢測的因素
采集的樣品
PMA偶聯熒光PCR技術對樣品的要求比較高。有研究發現,環境中的樣品,食品樣品和臨床上的病料中常常含有一些無機物質.有機物質。這些物質的存在既可以降低PMA的有效濃度,也可以干擾PMA與核酸的交聯反應。詳細的說,樣品中的無機物和有機物會造成樣品的濁度提高,樣品越渾濁,光的透過性就越差,越影響PMA與樣品在光照條件下的交聯反應。為了避免和減少因樣品采集帶來的誤差,Luo等人在一項研究中提出,要嚴格規范濁度的閾值,這樣對每一份樣品檢測具有更重要的意義和參考價值。有研究表明,當樣品的濁度達到10個散射濁度單位的時候,樣品的濁度對于PMA交聯DNA是沒有影響的。當樣品的濁度高于10個散射濁度時,樣品的濁度對于PMA交聯DNA具有非常大的影響。
PMA與DNA作用階段
PMA與DNA作用階段主要是指PMA進入細胞膜受損傷的過程和PMA結合DNA的過程。PMA是一種對光較為敏感的染料,即便在普通光源下,也能降低PMA的有效濃度。因此,在PMA與細胞核DNA作用的過程中要避光。在這個過程中,PMA的濃度、PMA與核酸的作用時間,溫度等都會影響終的檢測結果。有些學者在參考別的研究者活菌檢測技術時,設置了同樣的溫度、濃度和時間,但是結果卻不甚理想。其主要原因是樣品不同,佳的PMA的濃度和作用時間也會有很大的差異。如較低濃度時,PMA是不能夠完全結合掉的死菌DNA,那么部分沒有結合的死菌的DNA便可以作為模板被擴增出來,從而造成活菌檢測數據不準確。如果PMA的濃度過高,PMA也可以滲入到活的細胞中,將部分活的細胞DNA結合掉,造成檢測結果的不準確。因此,無論是做哪一項活菌檢測,PMA的濃度和作用時間等參數要先優化,后使用。PMA進入細胞的效率和有效結合DNA的效率還與溫度有關。有研究表明。在室溫的條件下,PMA結合DNA的效率高。另外,PMA與細胞的作用時間也要考慮到位。作用時間過長,PMA也能夠滲透到活細胞中,造成結果的不準確。








 添加微信咨詢!
添加微信咨詢!